3.3.8 Ácidos, bases y pH
Desde hace siglos, los químicos definieron los ácidos y las bases según las propiedades de sus disoluciones acuosas: así, un ácido es una sustancia cuya disolución acuosa posee un sabor agrio, tiñe de rojo el papel tornasol azul, reacciona con los metales activos, con desprendimiento de hidrógeno y neutraliza las bases.
De manera análoga, se define una base como la sustancia cuya disolución acuosa posee un sabor amargo, tiñe de azul el papel tornasol rojo, tiene aspecto jabonoso y neutraliza los ácidos.
Estas sustancias, al disolverse con agua, forman parte de compuestos clave para los sistemas biológicos.
Un ácido, al reaccionar con una base o viceversa, se neutraliza, y se obtiene como resultado una sal y agua:
Tomando en cuenta el tipo de enlace químico que presentan las sustancias, al estar en disolución acuosa, pueden presentar una disolución o una ionización.
La disociación la presentan sustancias que tienen enlace iónico y se define como la separación de los iones existentes en una sustancia iónica, cuando se encuentran en disolución acuosa o en estado líquido. Ejemplo:
En cambio, la ionización la presentan las sustancias con enlaces covalentes polares y se definen como el proceso mediante el cual una molécula se divide en una parte positiva y otra negativa, por separación asimétrica de los pares de electrones de enlace. Ejemplo:
Teorías ácido-base
Teoría de Arrhenius
En 1884, el químico sueco, Svante Arrhenius, definió un ácido como toda sustancia que al estar en disolución acuosa produce iones hidrógeno (H+), o bien, iones hidronio (H3O+), y a una base como toda sustancia que al estar en disolución acuosa produce iones oxhidrilo (OH-).
Esta teoría esta restringida en el sentido de que el concepto se limita al disolvente agua.
Teoría de Brönsted-Lowry
En 1923, Johannes Nicolaus Brönsted (en Dinamarca) y Thomas Martin Lowry (en Inglaterra) propusieron de manera independiente que los ácidos podrían definirse como donadores de protones y las bases como aceptores de protones.
Las reacciones de neutralización implican una transferencia de protones. Las sales son sólo agregados de iones que se producen en la mayoría de las reacciones de neutralización.
Al perder un protón (ion hidrógeno, H+), un ácido forma una base pues, por la reacción inversa, la sustancia formada puede ganar un protón (ion hidrógeno, H+).
Del mismo modo, una base forma un ácido al ganar un protón. Ejemplos:
El ácido y la base representados en las ecuaciones (1) y (2) son un par conjugado; es decir, un ácido forma su base conjugada al perder un protón y una base forma su ácido conjugado cunado gana un protón. Ejemplos:
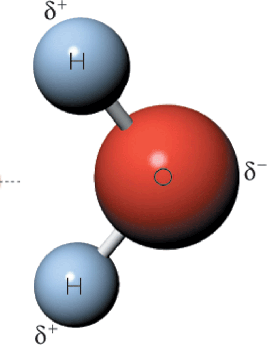
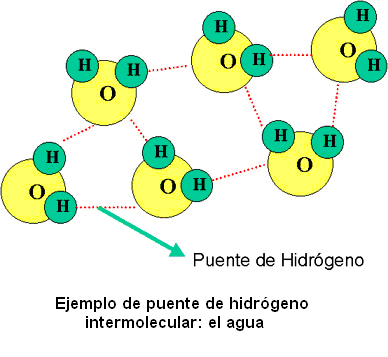
En los ejemplos anteriores observamos que el agua actúa como ácido y como base, respectivamente. De acuerdo con este concepto, el agua es anfótera (sustancia que en disolución acuosa puede ceder iones H+ e iones OH-).
Teoría de Lewis
En 1923, el estadounidense Gilbert Newton Lewis propuso un concepto más general, la teoría electrónica:
"Base es una sustancia que contiene un átomo capaz de ceder un par de electrones, y un ácido es una sustancia que contiene un átomo capaz de aceptar un par de electrones"
Cuando un ácido de Lewis reacciona con una base de Lewis, se forma, como consecuencia, un enlace covalente por coordinación.
Clasificación de ácidos y bases
Los ácidos y las bases se clasifican en fuertes y débiles.
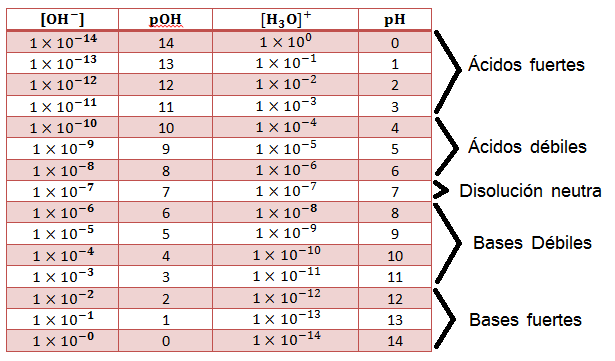
Tipos de ácidos y bases en función de la concentración de iones [H3 O+] y [OH-]
Ácido fuerte
Es toda sustancia que al disolverse se ioniza con gran facilidad produciendo un aumento en la concentración de iones hidronio y, por tanto su pH será bajo (0 a 3).
Ácido débil
Si una sustancia al disolverse no se ioniza con gran facilidad, produciendo una baja concentración de iones hidronio (no menos de 10-7 mol/L); su pH será relativamente alto (4 a 6.9), entonces podemos afirmar que se trata de un ácido débil.
Base fuerte
Cuando una sustancia, al disolverse, se ioniza fácilmente aumentando la concentración de iones oxhidrilo (OH-) se le conoce como una base fuerte.
Base débil
Si una sustancia, al disolverse, se ioniza con gran facilidad, produciendo una baja concentración de iones oxhidrilo, su pH será relativamente alto (7.1 a 11)
Para medir el pH de las soluciones utilizamos tiras de papel universal, cuya coloración especifica el valor que le corresponde. Sin embargo, en la actualidad se cuenta con instrumentos más precisos llamados potenciómetros, de tipo digital, que expresan exactamente el valor del pH.