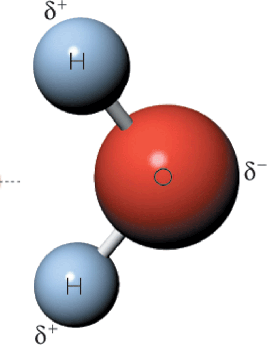
El agua está formada por dos átomos de hidrógeno y un átomo de oxígeno y formando un ángulo de 105° entre ellos. Los enlaces covalentes implican compartir electrones entre el hidrógeno y el oxígeno , el oxigeno atrae los electrones con mayor fuerza por lo que se forma una molécula polar en donde el oxígeno tiene una carga parcial negativa y el hidrógeno una carga parcial positiva
El oxigeno se apropia de los electrones compartidos con uno de los hidrógeno para formar una molécula polar (h+oh-)
Es un enlace entre moleculas más fuerte que otros de este tipo pero más débil en comparación con los enlaces convalentes o ionicos. La energia necesaria para romper un puente de hidrogeno equivale a alrederor de 5 kcal /mol; en cambio se necesitan de 80 a 100 kcal/mol para destruir un enlace covalente. En este enlcace un atomo de hidrogeno esta enlazado a un aromo pequeño muy electronegativo este atomo electronegativo atrae al hidrogeno formando un puente que une alas moleculas, a este enlace se debe la propiedad del agua de tener menor densidad en estado solido que en el liquido.
El puente de hidrogeno se presenta en las proteinas cuya estructura esta unida por enlaces de hidrogeno, este enlace es la fuerza que mantiene unido al ADN, el principal deposito de informacion genetica, lo cual se debe a la atraccion electrostatica entre el proton combinado y otro atomo de gran electronegatividad y volumen pequeño. El proton de una molecula atrae hacia el electrones solitarios de un atomo como el carbono de una molecula proxima o de la misma molecula, este puente de hidrogeno no es un verdadero enlace.
La sustancias de este tipo de enlace tienen puntos de ebullicion y fusion elevados y son líquidos de alto poder de disociación de los cristales ionicos, un ejemplo es el agua que por su fórmula debería ser un gas.
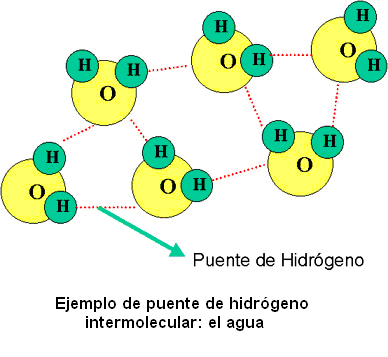
Cada molecula es individual y como resultado de la estructura abierta el volumen aumenta cuando el agua se congela.
El hielo es menos denso que esl agua porque presenta una estructura abierta con cadenas hexagonales que asemejan a un panal de abejas, elempaquetamiento de las moleculas en el agua liquida es apretado ocupa menos volumen que el hielo y causa que aumente la densidad .
La naturaleza polar de las moleculas de agua permite explicar su capacidad para disolver sustancias, su tension superficial y la accion capilar
Caracteristicas de las moleculas de importancia biologica que presentan un puente de hidrogeno
Es fundamental el estudio de las sustancias llamadas macromoleculas por su gran tamaño y peso; se conocen dos tipos: naturales (carbohidratos, lipidos y proteinas) y sinteticas
cuando los atomos son de distintos elementos los electrones se acomodan mas cerca del atomo que tiene mas afinidad hacia ellos, ala tndencia de los atomos de atraer electroones en un enlace se le conoce como electronegatividad, los elementos de mayor electronegatividad atraen con mas fuerza elementos menos negativos
Hay uniones que no pueden considerarse enlace, a estas uniones se les conoce como puentes de hidrogeno, se establecen entre un atomo de hidrogeno unido en enlace covalente a un atomo muy electronegativo y otro atomo menos electeonegativo asi que no son cargas totalmente positivas o negativas.
Gracias a los puentes de hidrogeno el agua se comporta como un liquido a temperatura ambiente, en los compuestos organicos se tienen:
Proteinas: Polimeros de moleculas llamadas aminoacidos que son un carbonoalfa unido a un hidrogeno, un gpo amino, un gpo carboxilo y una cadena lateral R
Acidos nucleicos: ADN y ARN son polimeros de moleculas llamadas nucleotidos, su estructura consiste en un gpo fosfato unido a un azucar de 5 carbonos (ribosa o desoxirribosa) unida a una base nitrogenada
Hidratos de carbono: Polimeros de monosacaridos
Lipidos: gpo carboxilo y cadena hidrocarbonada
un gpo muy diverso de proteinas tiene helice -a que se encuentra estabilizada por puentes de hidrogeno.
Los puentes de hidrogeno se forman desde el gpo carbonilo hasta el hidrogenode la amida del cuarto enlace peptidico siguiente.La hoja beta es otra forma de estructura en la que los componentes estan involucrados en la formacion de puentes de hidrogeno.